Os gases têm um papel essencial para a vida, os gases atmosféricos permitem, por exemplo, a respiração. Assim como eles são biologicamente essenciais, são cobrados em vestibulares tanto em questões de química como a física.
Indice
Variáveis de Estado
As variáveis de estado de um gás são: temperatura (T) que está associada á energia cinética das moléculas em movimento, o volume (V) que é o espaço ocupado pelo gás (os gases ocupam todo o volume dos recipientes que os contém) e a pressão (p) que é associada às colisões das moléculas do gás com as paredes dos recipientes. Essas variáveis descrevem a condição física do gás.
Mudanças de Estado
Para as mudanças de estado, mantemos sempre uma das variáveis de estado constante e variamos as outras duas que sobraram. Existem tipos de transformações, e elas dependem de qual a variável considerada como constante, abaixo estão descritas três mudanças de estado:
- Transformação isotérmica: nessa transformação a temperatura é a variável mantida
constante; - Transformação isométrica, isocórica ou isovolumétrica: nessa transformação o
volume é a variável mantida constante; - Transformação isobárica: nessa transformação a pressão é a variável mantida
constante;
Se nenhuma das três variáveis de estados forem constantes atemos a transformação geral.
Transformação isotérmica – Lei de Boyle
A pressão é o volume são variáveis inversamente proporcionais, ou seja, à medida que eu aumento a pressão eu diminuo o volume. A partir dessa afirmação concluímos que o produto da pressão pelo volume é uma constante, então escrevemos:
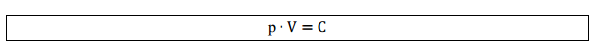
Assim, para transformações de um estado 1 para um estado 2 mantendo a temperatura constante:
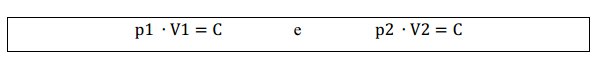
Igualando as duas equações:
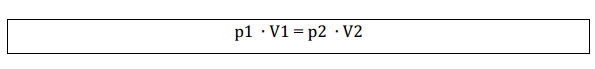
Graficamente representado por:
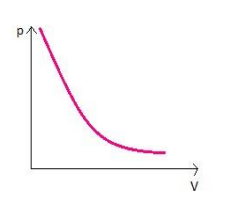
O gráfico descreve uma hipérbole, mostrando que o volume é inversamente proporcional à pressão como afirmado anteriormente. Essa curva recebe o nome de isoterma devido à temperatura constante. Em um gráfico como esse podem ser construídas várias isotermas ao mudar as temperaturas, mas mantê-las constantes.
Transformação isométrica – Lei de Gay-Lussac
À medida que aumentamos a temperatura de um gás, a pressão aumenta então as variáveis pressão e temperatura são diretamente proporcionais, ou seja:
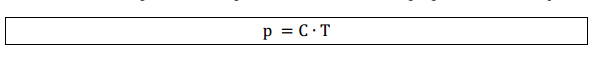
Assim, para transformações de um estado 1 para um estado 2 mantendo o volume constante:
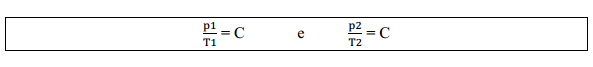
Igualando as duas equações:
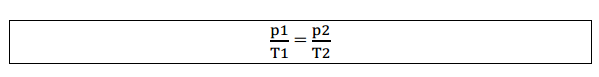
Graficamente representado por:
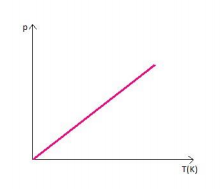
O gráfico descreve uma reta denominada isométrica, mostrando que a temperatura e pressão são diretamente proporcionais.
Transformação isobárica – Lei de Charles
À medida que aumentamos a temperatura de um gás, há um aumento de volume, mostrando que as variáveis temperatura e volume são proporcionais, ou seja:
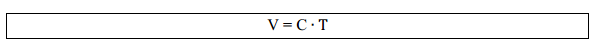
Assim, para transformações de um estado 1 para um estado 2 mantendo a pressão constante:
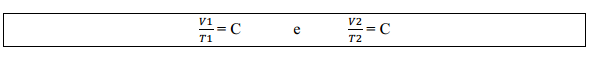
Igualando as duas equações:
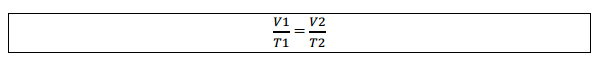
Graficamente representado por:
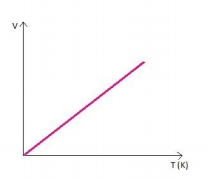
O gráfico descreve uma reta denominada isóbara, mostrando que a temperatura e volume são diretamente proporcionais.



1 comment
Quero o manual enem